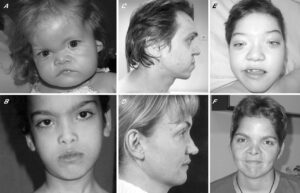
Beta-pervane proteini-ile ilgili nörodejenerasyon sinir sistemine zarar veren, ilerleyici, yani gitgide kötüleşen bir hastalıktır. Beyinde demir birikiminin gelişmesinin kişiye özel etkileri vardır ve medikal görüntüleme ile görüntülenebilir. Bu nedenle BPAN Beyinde Demir Biriktirmeyle Nörodejenerasyon(NBIA) denilen hastalığın bir çeşidi olarak sınıflandırılır, demir birikimini hastalığın geç dönemlerinde ortaya çıkmasına rağmen BPAN’lı birçok insanda süt çocukluğu döneminin başlangıcında ya da erken çocukluk döneminde nükseden nöbetler vardır. Bu rahatsızlıkta aynı bireyde olsa bile birkaç farklı tip nöbet meydana gelebilir.
Sıklıkla görülen ilk tip ateşli nöbetlerdir ki bu nöbetler yüksek ateşte tetiklenir. Etkilenen bireyler ayrıca genelleşmiş tonik-klonik nöbetler deneyimleyebilirler (ayrıca Grand Mal nöbeti olarak bilinir). Bu tip bir nöbet tüm vücudu etkiler, kas rijiditesine, konvülsiyona ve bilinç kaybına sebep olur. Hastalıkta diğer oluşabilecek nöbet tipleriyse; hareketsiz kalma görüntüsü ya da hayallere dalmak gibi kısa farkındalık boşluklarını içeren yokluk nöbeti denilen bir tip nöbettir. (Petit Mal nöbeti olarakta isimlendirilebilir), aniden kas tonusunun azalması (atonik nöbet), istemsiz kas seyirmeleri(miyoklonik nöbet) yada göze çarpan hareketler şeklinde görülen epileptik spazm denen nöbetlerdir. Bazı bireylerde, West Sendromu ya da Lennox-Gastaut Sendrorumunda olduğu gibi epileptik sendromları anımsatan nöbet paternleri vardır.
BPAN’lı çocukların ayrıca zihinsel engeli vardır, gelişimin gecikmesi kelime ve konuşma üretmede önemli problemleri (dilin etkili bir biçimde kullanımı) hareketlerin koordine edilmesinde zorluğu(ataksi) kapsar. Ataksi yürüme becerisini ve malzeme kullanmak gibi iyi motor becerileri yerine getirmeyi etkiler. Etkilenen kişilerin davranışsal değişiklikleri olabilir sıklıkla Rett Sendromu olarak adlandırılan hastalığın özellikleriyle karşılaştırılır. Bu özellikler tekrarlayıcı el sıkma ve bükme (basmakalıp el hareketleri); diş gıcırdatma(bruksizm); uyku rahatsızlıkları ve Otizm Spektrum Bozukluğunun karakteristik özelliği olan iletişim ve sosyal etkileşimde problemlerdir.
Geç ergenlik ya da erken yetişkinlikte olan BPAN’lı kişilerin zihinsel fonksiyonlarında gittikçe artan kayıplar (kognitif gerileme) düşünme ve muhakeme yeteneklerinde şiddetli kayıplara yönlendirebilir. Hareketle ilgili daha kötü problemler Parkinsonizm ve distoni meydana gelmesini de kapsar. Distoni sürekli kas kontraksiyonlarıyla karakterize istemsiz bir durumdur. BPAN’da distoni sıklıkla kollarda başlar. Parkinsonizm olağandışı yavaş hareketler(bradikinezi), rijidite, tremorlar, vücudu dik ve dengede tutamama (postüral instabilite) ve sürekli düşmelere sebep olan ayakta sürüyerek yürüme tarzını kapsar.
BPAN’lı insanların ömrü değişir. Onların işaretleri ve semptomlarının uygun yönetilmesiyle etkilenmiş bireyler orta yaşa kadar yaşayabilirler. Ölüm demansın komplikasyonlarından ya da hareket problemlerinin sonucunda olabilir, düşme sonrası yaralanma gibi ya da yutma zorlukları(disfaji) aspirasyon pnömonisi denilen bakteriyel akciğer enfeksiyonuna yönlendirebilir.
Görülme Sıklığı
BPAN nadir bir hastalıktır. Prevelansı bilinmiyor ama vakaların %1-2 arasında NBAI hastası olduğu düşünülüyor. 100 etkilenmiş kişi hakkında medikal literatür tanımlanmıştır. Zihinsel engel teşhisi konulmuş ya da erken Parkinsonizm teşhisi konmuş bazı hastaların semptomlarına ve işaretlerine dayanarak genetik test bittiğinde BPAN olduğu sonradan bulunmuştur.
Hastalığın Nedenleri
WDR45 genindeki mutasyonlar BPAN’a sebep olur. Bu gen WIRI4 proteinin yapımı için talimatlar verilmesini sağlar. WIPI4 7 kanatlı bir pervaneyi andıran karakteristik bir yapıya sahiptir, hastalığın adı buradan türemiştir. WIPI4 proteini otofaji denilen bir süreci içine alır, bu süreç ihtiyaç olmayan materyalleri hücreden temizlemeye yardım eder, ferritin denilen demir depolama proteini miktarının aşırı olmasını da kapsar.
BPAN tanımlanan insanların WDR45 gen mutasyonlarının çoğunda sonuç olarak WIPI4 proteinin çalışması bulunmamaktadır (yani WIPI4 işler durumda değildir). Sonuç olarak, otofaji süreci bozulmuştur, zararlı hücre yapılarının ve atık maddelerin uzaklaştırılmasında hücre yapımı daha az verimli hale gelir. Araştırmacılar öneriyor ki o sinir hücreleri otofajinin harabiyeti için özellikle korunmasız olabilirler çünkü uzun uzantıları var (akson ve dendrit), bu yapılardan hücre gövdesine atık maddelerin başka bir bölgeye taşınması daha da zor hale gelir bu alan geri dönüşümün olacağı alandır(lizozom). Atık maddeler bu alanda güçlenebilir ve onlara zarar verebilir. BPAN’da meydana gelen nörolojik problemler sinir hücrelerinin zarar görmesinin sonucudur.
Kalıtım Paterni
Bu durum X’e bağlı dominant paternle aktarılır. Bu durumla ilişkili gen X kromozomu üzerine yerleşmiştir, cinsiyet kromozomlarının 2’sinden birisidir. Kadınlarda (2 X kromozomuna sahiptirler) her hücrenin 1 ya da 2 kopyasında gen mutasyonu bu hastalığa sebep olmak için elverişlidir. Erkeklerde (1 X kromozomuna sahiptirler) her bir hücrede 1 kopyada mutasyon hastalığa sebep olur. X’e bağlı kalıtımın karakteri babaların X’e bağlı özellikleri oğullarına geçemez.
X’e bağlı dominant hastalıkların çoğunluğunda, erkeklerin semptomları kadınlarınkine göre daha şiddetlidir. BPAN vakaları her zaman böyle değildir, çoğunlukla etkilenen kişiler kadınlardır, çünkü büyük ihtimalle etkilenmiş erkekler az sayıda olup doğumdan sonra hayatta kalabilirler. Neredeyse BPAN’ın tüm vakaları ailede hastalık hikayesi olmaksızın gendeki mutasyonun meydana gelmesi sonucu oluşur.
Nadiren, etkilenmiş kişi mutasyonu biraz etkilenmiş annesinden miras olarak alır. Raporlanmış vakalar arasında, BPAN’lı erkekler ve çoğu BPAN’lı kadın çocuk sahibi olamamış.
Hastalığın Diğer İsimleri
•BPAN
•NBIA 5
•Beyinde Demir Biriktirmesiyle birlikte Nörodejenerasyon 5
•SENDA
•Çocuklukta Statik Ensefaopati ile birlikte Yetişkinlikte Nöradejenerasyon
•WDR45
•WD Tekrarlayan Alan 45
Normal Fonksiyon
WDR45 geni WD40 phosphonositides ile birlikte etkileşen tekrarlı protein denen proteinin yapılması için talimatları sağlar. WIPI4 karakteristik yapısı 7 kanatlı pervaneyi andıran bir grup proteinin bir üyesidir.WIPI4 proteini otofaji denilen sürecin erken evrelerini içine alır, ihtiyaç olmayan materyallerin hücreden temizlenmesine yardım eder, ferritin denen demir depolama proteininin miktarının aşırı olmasını kapsar. Otofajide işi bitmiş hücre parçaları (organeller gibi, hücrenin içinde kesin görevlerini yerine getiren özelleşmiş yapılardır) ve diğer materyaller otofagozomlar denilen küçük bir alanın içinde izole edilmiş ve artık ihtiyaç olmayan materyallerdir. WIPI4 protein materyallerden otofagozomun uzamasının ve üretilmesinin düzenlenmesine yardım eder. Sonrasında otofagozomlar lizozom denilen organele taşınırlar, bu yapı hücrenin geri dönüşümü rolünü gerçekleştirir. Lizozomlar atık maddeleri sindirim enzimi kullanarak işlevsiz hale getirir ve işi bitmiş hücre bölümlerini geri dönüştürür.
Genetik Değişikliklerle İlgili Sağlık Durumları
BPAN’lı insanlarda WDR45 geninin 50’den fazla mutasyonu tanımlanmıştır, bu hastalık sinir sistemine zarar verir. Bu zarar süt çocuğu döneminin ve erken çocukluk döneminde gelişimin gecikmesine ve tekrarlayan nöbetlere yönlendirir, zamanla kötüleşen hareket problemleri ve yetişkinlikte gittikçe artan entelektüel fonksiyon kaybı görülür. Etkilenmiş kişilerde en sonunda demir birikmesi vardır bu medikal görüntülemeyle görüntülenebilir; bu nedenle, BPAN beyinde demir birikmesiyle nörodejenerasyon (NBAI) denilen hastalığın bir tipidir.
BPAN’ da WDR45 gen mutasyonları tanımlanmış insanlarda sabit olmayan WIPI4 proteininin üretiminin hızla bozulması sonucu oluştuğu düşünülüyor, bu durum WIPI4 proteininin fonksiyonunu kaybetmesine yönlendiriyor. Fonksiyonel WIPI4 proteini olmadan, otofaji süreci bozulur, hücredeki zararlı organellerin ve atık maddelerin uzaklaştırılmasında hücre yapımı daha az etkili olur. Araştırmacılar öneriyor ki sinir hücreleri otofajinin harabiyeti için özellikle korunmasız olabilirler çünkü uzun uzantıları var (akson ve dendrit), bu yapılardan hücre gövdesi üzerinden lizozoma geri dönüşüm için atık maddelerin taşınmasını daha zor hale getirir. Atık maddeler bu alanda güçlenebilir ve onlara zarar verebilir. BPAN’ da meydana gelen nörolojik problemler sinir hücrelerinin zarar görmesinin sonucudur.
Kromozomal Lokasyon
Sitogenetik Lokasyon:Xp11.23 X kromozomunun pozisyon 11.23’te kısa p kolunda
Moleküler Lokasyon:X kromozomunun 49,074,433’ten 49,101,121’e kadar olan baz çiftleri
Bu gen için diğer isimler
JM5
NBIA4
NBIA5
WD tekrarlayan alan phosphoinositide ile etkileşen protein 4 izoform 1
WD tekrarlayan alan phosphoinositide ile etkileşen protein 4 izoform 2
WD tekrarlamayı içeren protein 45
KAYNAKÇA