GENEL BİLGİ
Lowe sendromu öncelikli olarak gözleri, beyni ve böbrekleri etkileyen bir sendromdur. Bu hastalık neredeyse sadece erkeklerde ortaya çıkmaktadır.
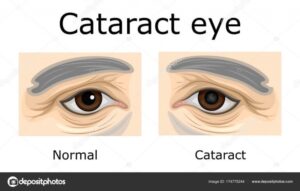
Lowe sendromuna sahip bebekler kalın ve bulanıklaşmış göz lenslerine sahip olarak doğarlar (doğuştan gelen katarakt*),genellikle görüşü bozabilecek başka göz bozukluklarına da sahip olabilirler. Bu hastalık ile doğan bebeklerin yaklaşık %50’sinde çocuk glokom’u* adı verilen göz problemi gelişir.

Lowe sendromuna sahip birçok bireyde gelişim geriliği görülmekte ve zihinsel yeterlilik aralığı normale göre ciddi anlamda bozulmuş olmaktadır. Sendromlu çocukların birçoğunda beslenme zorlukları, soluk alıp verme problemlerine yol açan, aynı zamanda oturma, kalkma, yürüme gibi motor yeteneklerin geç gelişmesine de neden olan, doğuştan gelen ‘güçsüz-zayıf kas tonusu (neonatal hipotoni*) ‘ görülmektedir.
Böbrek anormallikleri, en yaygın olarak bilineni olan Fanconi sendromu, sıklıkla Lowe sendromlu bireylerde gelişir. Böbrekler vücuttaki mineral, tuz, su ve diğer maddelerin normal oranda korunmasında önemli bir rol oynar. Fanconi sendromu olan bireylerde ise; böbrekler, önemli besin maddelerini kan dolaşımına geri alamazlar. Dolaşıma geri alınamayan besinler idrarla dışarı atılır. Bu böbrek problemi; idrara çıkmada artış, dehidratasyon* ve kan asit miktarının anormalleşmesi (metabolik asidozis*) gibi birçok probleme de öncülük eder. Tuz ve besin maddelerinin kaybı büyüme ve gelişmede bozukluklara sebep olabilir ve yumuşak, eğri kemiklerin oluşmasına sebep olabilir (hipofosfatemik rikets*) özellikle de bacaklarda. Lowe sendromlu erişkinlerde ve büyük çocuklarda ilerleyen böbrek problemleri, yaşamı tehdit eden böbrek yetmezliği ve son dönem böbrek yetmezliğine yol açabilir.
GÖRÜLME SIKLIĞI
Lowe sendromu çok yaygın görülmeyen bir durumdur. Görülme sıklığı 500 bin ’de 1’dir.
GENETİK DEĞİŞİKLİKLER
OCRL geni mutasyonları Lowe sendromuna sebep olur. OCRL geni, hücre zarında bulunan yağların (fosfolipid) modifiye edilmesine yardımcı olan enzimin yapımında görev alan gendir. OCRL enzimi belirli maddelerin hücre zarından veya hücre zarına taşınmasında yardımcıdır. Aynı zamanda bu enzim hücre iskeleti olan aktin’in düzenlenmesinde de görev alır. Aktin, hücre yapısının oluşmasını sağlayan ağ benzeri yapılardır. Hücre şeklini belirlemek ve hücre hareketini sağlamak da dahil olmak üzere birçok önemli görevleri vardır.
OCRL geninde olabilecek bazı mutasyonlar OCRL enziminin üretimini engelleyebilir. Diğer mutasyonlar ise enzim aktivitesini azaltabilir ya da ortadan kaldırabilir veya hücre içindeki diğer proteinlerle olan etkileşimini önleyebilir. Araştırmacılar, OCRL mutasyonunun Lowe sendormunun karakteristik özelliklerine nasıl sebep olduğunu belirtmek için çalışıyorlar. OCRL enzimi tüm vücutta bulunmasına rağmen, sendrom görülen insanlarda görülen problemlerin neden özellikle beyin, böbrek ve gözlerde oluştuğu belirlenememiştir. Etkilenmemiş dokulardaki diğer enzimlerin OCRL enziminin eksikliğini telafi ediyor olabileceği ihtimali mümkün olabilir.
KALITIM MODELİ
Bu sendrom X’e bağlı kalıtımla aktarılan bir durumdur. Bozukluğa neden olan mutasyona uğramış gen, iki cinsiyet kromozomundan biri olan X kromozomunda bulunuyorsa, X’e bağlı bir durum olarak kabul edilir. Erkeklerde (sadece bir tane X kromozomuna sahipler) bozulmuş bir gen bile hastalığın görülmesine neden olur. Kadınlarda (iki tane X kromozomu taşırlar), hastalığın ortaya çıkması için mutasyon genlerin ikisinde de olmalıdır. X’e bağlı bozukluklar erkekleri, kadınlardan daha sık oranda etkilemektedir. X’e bağlı karakteristik özellikler babadan oğula aktarılamaz.
Bazı Lowe sendromu vakalarında, mutasyona uğramış tek OCRL geni taşıyan anne, bunu erkek çocuğuna aktarır ve hasta erkek çocuk doğar. Diğer vakalarda ise aile hikayesinde bir bozukluk olmamasına rağmen gende yeni bir mutasyon gerçekleşir ve erkekte sendrom ortaya çıkar.
OCRL geninin mutasyona uğramış bir kopyasına sahip taşıyıcı kadınlarda sendromun karakteristik özellikleri görülmez. Buna rağmen birçok taşıyıcı kadının göz merceğinde, kapsamlı göz muayenelerinde gözlemlenebilen değişikler vardır fakat bu değişiklikler görmeyi bozmaz.
SENDROMUN DİĞER İSİMLERİ
-Serebro Okulo Renal Sendrom
-Lowe Okuloserebro Renal Sendrom
-Fosdatidilinositol -4,5-bifosfat-5-fosfataz Eksikliği
TERİMLER
*Katarakt: Göz bebeğinin arkasında bulunan ve görmeyi sağlayan doğal göz merceğinin saydamlığını kaybederek matlaşmasıdır.
*Glokom: Optik sinirin (gözden beyne iletiyi götüren sinir ) gözü terk ettiği yerde hasara uğraması ile neticelenen bir durumdur. Bu tür hasar görme kalitesini etkilemektedir. Çocuklarda görülen bu tür hasar hemen hemen her zaman yüksek göz içi basıncı ile seyreder.
*Hipotoni: Kas kaybı anlamına gelmektedir.
*Dehidratasyon: Su kaybı demektir. Çoğunlukla tuz kaybıyla da birlikte görülür.
*Metabolik Asidoz: Böbrekler yoluyla atılması gereken asit iyonlarının birikmesi veya aşırı bikarbonat iyonunun kaybedilmesi durumudur.
*Hipofosfatemik Rikets: Renal fosfat kaybı sonucunda kemik mineralizasyonunun yetersiz olduğu bir klinik tablodur.
KAYNAKÇA
https://ghr.nlm.nih.gov/condition/lowe-syndrome#sourcesforpage
Attree O, Olivos IM, Okabe I, Bailey LC, Nelson DL, Lewis RA, McInnes RR, Nussbaum RL. Lowe’nin oküloserebrorenal sendromu geni, inositol polifosfat-5-fosfataz ile yüksek oranda homolog olan bir proteini kodlar. Doğa. 1992 Jul 16, 358 (6383): 239-42.
Erdmann KS, Mao Y, McCrea HJ, Zoncu R, Lee S, Cennet S, Modregger J, Biemesderfer D, Toomre D, De Camilli P. Endoktik yolun erken aşamalarında Lowe sendromu proteini OCRL’nin bir rolü. Dev Hücre. 2007 Eylül, 13 (3): 377-90.PubMed’de veya PubMed Central’daki ücretsiz makalede alıntılama.
Lewis RA, Nussbaum RL, Brewer ED. Lowe Sendromu. 2001 Tem 24 [güncellenen 2012 Feb 23]. İçinde: Pagon RA, Adam MP, Ardinger HH, Wallace SE, Amemiya A, Fasulye LJH, Kuş TD, Ledbetter N, Mefford HC, Smith RJH, Stephens K, editörler. GeneReviews® [İnternet]. Seattle (WA): Washington Üniversitesi, Seattle; 1993-2017. Http://www.ncbi.nlm.nih.gov/books/NBK1480/
Loi M. Lowe sendromu. Orphanet J Nadir Dis. 2006 Mayıs 18,
Lowe M. Lowe sendromu proteininin yapısı ve fonksiyonu OCRL1. Trafik. 2005 Sep; 6 (9)
Schurman SJ, Scheinman SJ. Kalıtsal serebrorenal sendromlar. Nat Rev Nefrol. 2009 Eylül, 5 (9): 529-38. doi: 10.1038 /
http://ilgazyalvac.com/cocuklarda-glokom-ve-bilmediklerimiz/
https://doktordanhaberler.com/lowe-sendromu/
https://www.news-medical.net/health/What-is-hypotonia-(Turkish).aspx
http://www.wikizero.co/index.php?q=aHR0cHM6Ly90ci53aWtpcGVkaWEub3JnL3dpa2kvTWV0YWJvbGlrX2FzaWRveg
http://www.turkiyeklinikleri.com/article/tr-hipofosfatemik-rikets-62730.html